![]() Traduzione di Natale
Marzari
Traduzione di Natale
Marzari
Home,
Ricerca,
Indice alfabetico,
Collegamenti,
Patologia,
Molecole,
Sindromi,
Muscoli,
Gionezioni neuromuscolari,
Nervi,
Spinale,
Atassia,
Anticorpi e Biopsia,
Informazioni per i
pazienti

| Fondazione FONAMA | fonama@fonama.org | Telefono 335250742 |
|
|
 |
Traduzione del 25 marzo 2021
|
Home, Ricerca, Indice, Collegamenti, Patologia, Molecole, Sindromi, Muscoli, Gionezioni neuromuscolari, Nervi, Spinale, Atassia, Anticorpi e biopsia, Informazioni per i pazienti |
|
Trasporto assonale Biogenesi Fissione e Fusione Funzioni del DNA Origine Proteine Struttura |
|
Generale Biogenesi Spazio intermembrane (IMS) Matrice Membrane Interna Esterna Portatrici di soluti Mitoribosomi Submitocondriali Altre Correlate al mtRNA |
|
AARS2: Cardiaco ACAD8 ACAD9: Affaticamento ACADM: Affaticamento + CNS ACADS: CNS; PEO ACADSB ACAT1 ALAS2: Anemia ALDH2 ALDH4A1 ALDH5A1 ALDH6A1 AMT ATP5F1D: Encefalopatia ATPAF2: Dismorfico, Cardiaco AUH BCAT2 BCKDHA BCKDHB: Malattia delle urine sciroppose BCS1L: GRACILE C1QPB: Cardiomiopatia; PEO c8orf38: Leigh c10orf2: PEO; SANDO c12orf65: Leigh+ c20orf7: Leigh+ CA5A: Encefalopatia CARS2: Encefalopatia CLPP COA5: Cardiomiopatia COA6: Cardiomiopatia COA7: SCAN3 COASY: NBIA COX10: Encefalopatia COX15: Leigh+ COX20 (FAM36A): Atassia CPS1 |
D2HGDH
DARS2: LBSL DBT DECR1 DGUOK: Epatocerebrale , DLD: Encefalopatia DLAT: Encefalopatia DMGDH DNA2: Miopatia + PEO EARS2: Leucoencefalopatia ECHS1: Simil-Leigh ETFA: Miopatia ETFB: Aciduria glutarica FARS2: Alpers FH: Encefalopatia FOXRED1: Leigh FDX1L: Miopatia + rabdomiolisi GCDH GCSH GFM1: Epatoencefalopatia GLUD1 HADH HARS2: Perrault 2 HIBCH: Simil-Leigh HMGCS2: Encefalopatia HMGCL HSD17B10: Ritardo HSPD1: SPG13 IDH2 IDH3B ISCU: Miopatia IVD KARS: Neuropatia LARS2: Diabete; Perrault; HLASA LYRM7: Encefalopatia MARS2: Atassia spastica |
MCCC1
MCCC2 MCEE MDH2: Encefalopatia ME2 MGME1: PEO + Miopatia MRPL3: Cardiomiopatia MRPL12: CNS e ritardo della crescita MRPL44: Cardiomiopatia MRPS2: Sordità e ipoglicemia MRPS7: Sordità + Sistemico MRPS14: Cardiomiopatia e CNS MRPS16: Acidosi MRPS22: Cardiomiopatia MRPS23: Epatico malattiaMRPS25: Encefalomiopatia MRPS28: multisistema MRPS34: Leigh MTFMT: Leigh MTPAP: SPAX4 MUT NAGS NDUFAF1: Cardiomiopatia+ NDUFAF2: Leucoencefalopatia NDUFAF3: Encefalopatia NDUFAF4: Encefalopatia NDUFAF8: Simil-Leigh NDUFB8: Simil-Leigh NSUN3: Encefalomiopatia NUBPL: Encefalomiopatia OAT: Atrofia circinata OGDH OTC OXCT1 PC: Atassia+ PCCA: Carenza di biotidinasi |
PCCB
PCK2 PDHA1: Encefalopatia PDHB: Encefalopatia PDHX: Leigh PDK3: CMTX6 PDP1: Encefalopatia PET117: Encefalopatia PITRM1: Atassia + ritardo POLG: PEO POLG2: PEO PYCR1 RARS2: PCH6 RMRP: Ipoplasia cartilagine-capelli SARDH SARS2: Metabolico SCO1: Epatoencefalopatia SCO2: Cardioencefalomiopatia SDHAF1: Leucoencefalopatia SDHAF2: Paraganglioma 2 SOD2 SUCLA2: Encefalomiopatia SUCLG1: Acidosi lattica neonatale SURF1: Leigh; CMT4 TACO1: Leigh TK2: Miopatia TMEM70: Encefalocardiomiopatia TOP3A: PEOB5 TRMT5: Intolleranza all'esercizio fisico; Disturbo multisistemico TRMU: Insufficienza epatica TSFM: Cardioencefalomiopatia TTC19: Atassia ed encefalopatia TUFM: Encefalopatia TXN2: Neurodegenerazione UNG XPNPEP3 YARS2: Miopatia + Anemia |
|
ABCB7: Atassia + Anemia ACADVL: Miopatia ADCK3: SCAR9 AGK: Sengers ATP5A1: Encefalopatia, neonatale ATP5E: Ritardo + neuropatia ATP5MD: Encefalopatia, infantile BRP44L: Encefalopatia c12orf62: Encefalocardiomiopatia Cardiolipina: Barth COA3: Neuropatia + Affaticamento COQ4: Encefalopatia + Sistemico COQ5: Atassia + COX4I1: Encefalopatia COX4I2: Pancreas + Anemia COX5A: Sistemico COX6A1: CMT COX6A2: Miopatia COX6B1: Encefalomiopatia COX7B COX8A: Leigh + Epilessia COXFA4: Encefalopatia CPT2: Miopatia CRAT: Encefalomiopatia CYC1: Iperglicemia ed encefalopatia CYCS CYP11A1 CYP11B1 CYP11B2 CYP24A1 CYP27A1: Xantomatosi Cerebrotendinea CYP27B1 DHODH DNAJC19: Cardiaco + atassia DNAJC30: LHON ETFDH: Miopatia FASTKD2: Encefalomiopatia GPD2 HADHA: Multisistema; Miopatia HADHB: Encefalomiopatia HCCS: MIDAS |
L2HGDH: Encefalopatia LONP1: CODAS MMAA MICOS13: Encefalopatia MICU1: Miopatia + Movimento MICU2: Encefalopatia MPV17: Epatocerebrale NDUFA1: Encefalopatia NDUFA2: Leigh + Cardiaco NDUFA4: Leigh NDUFA6: Encefalopatia NDUFA9: Leigh; Distonia NDUFA10: Leigh NDUFA11: Encefalocardiomiopatia NDUFA12: Leigh NDUFA13: Encefalopatia + Ottica NDUFB3: Infantile letale NDUFB9: Encefalopatia NDUFB10: Neonatale letale NDUFB11: MLS NDUFV1: Encefalopatia NDUFV2: Encefalopatia + Cardiaco NDUFS1: Leucodistrofia NDUFS2: Encefalopatia + Cardiaco NDUFS3: Distonia NDUFS4: Encefalopatia NDUFS6: Infantile letale NDUFS7: Encefalopatia NDUFS8: CNS + Cardiaco OPA1: Atrofia ottica OPA3: Atrofia ottica Paraplegina: SPG7 PDSS1: Carenza di coenzima Q10 PET100: Leigh PMPCA: Atassia PMPCB: Encefalopatia RMND1: Encefaloneuropatia |
SDHA: Leigh; Cardiaco; Paraganglioma SDHB: Paraganglioma; Leucoencefalopatia SDHC: Paraganglioma SDHD: Paraganglioma SFXN4: Anemia + CNS SLC25A: Portatori 250 SLC25A1: Encefalopatia epilettica, CMS23 SLC25A3: Cardiaco; Intolleranza all'esercizio fisico SLC25A4: PEOA2 SLC25A8 (UCP2) SLC25A9 (UCP3) SLC25A10 (DIC): Encefalopatia epilettica + Carenza del complesso I SLC25A12: Ipomielinizzazione SLC25A13: Citrullinemia SLC25A15: HHH SLC25A16: Displasia delle unghie SLC25A19: Microcefalia SLC25A20: Encefalocardiomiopatia SLC25A21 (ODC): MTDPS18, disturbo simile alla SMA SLC25A22: Epilessia mioclonica SLC25A24: Sindrome progeroide SLC25A26: Encefalomiopatia SLC25A32: Intolleranza all'esercizio fisico SLC25A38: Anemia SLC25A42: Miopatia Vedi anche: SLC25A46 (Membrana esterna) TMEM65: Encefalopatia TMEM126B: Affaticamento e intolleranza all'esercizio fisico TIMM8A: Sordità-Distonia-Demenza TIMM22: Encefalopatia TIMM50: Encefalopatia (MGCA9) UCP1 UQCC2: Encefalopatia UQCC3: Encefalopatia UQCRB: Ipoglicemia, Epatico UQCRC1: Parkinson + PN UQCRC2: Encefalopatia metabolica episodica UQCRQ: Encefalopatia YME1l1: Atrofia ottica + |
|
Differenze dal DNA nucleare Eredità Variazioni del Mutazioni del mtDNA e Disturbi Meccanismi patogenici Struttura Trascrizione e traslazione |
|
Collegamento esterno: Energetiche mitocondriali Normale Diabete |
|
Generale Mutazioni puntiformi mtRNA Delezioni e duplicazioni Cambiamenti quantitativi Disturbi specifici 2° a mutazioni nucleari |
|
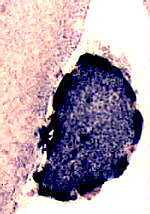 Intensa colorazione SDH di una fibra muscolare con proliferazione mitocondriale |
|
Imaging Genetica molecolare Biopsia muscolare Siero Urina |
|
Colorazione La colorazione COX SDH Altre colorazioni Fosforilazione ossidativa Ultrastruttura |
| DISTURBI MITOCONDRIALI: SINDROMI CLINICHE | ||||
| ||||
|
Classificationi dei disturbi mitocondriali Biochimica Clinica Genetica: mtDNA; Nucleare | ||||
|
Clinica Genetica Laboratorio Proteina TP Varianti Vedi anche MNGIE (MTDPS4B): Mutazioni POLG Recessiva PEO + Miopatia: MGME1 |
|
Genetica MTND1 MTND4 MTND6 Altro Clinica Laboratorio Neuropatia ottica Altro Vedi anche: LHON, Recessiva |
| PEO: Caratteristiche generali | |||
|
PEO dominante DNA mitocondriale Δ Delezioni multiple del Mutazioni del mtDNA del DNA nucleare (PEOA) POLG (PEOA1): 15q25 SANDO MIRAS MSCAE Alpers Parkinson ANT1 (PEOA2): 4q35 Twinkle (PEOA3): 10q23 POLG2 (PEOA4): 17q RRM2B (PEOA5): 8q23 DNA2 (PEOA6): 10q21 OPA1: 3q28 Ipogonadismo SCA28: AFG3L2; 18p11 |
PEO recessiva DNA mitocondriale Δ Deplezione del mtDNA, o Delezioni multiple del Mutazioni del mtDNA del DNA nucleare (PEOB) Leigh, PEO, OA: c12orf65; 12q24 MNGIE: TYMP; 22q13 POLG1: 15q26 HSN + PEO (SANDO) PEOB1 PEO + cardiomiopatia PEO+ CNS PEOB2: RNASEH1; 2p25 PEOB4: DGUOK; 2p13 PEOB5: TOP3A; 17p11 Miopatia MGME1; 20p11 PEOB3; TK2 16q21 Cardiomiopatia Cardiomiopatia POLG1 C1QBP Miopatia e Parkinsonismo Neuropatia sensoria SPG7 variante: Paraplegina; 16q24 |
PEO materna DNA mitocondriale Δ Mutazioni puntiformi del mtDNA Possono essere sporadiche mtRNALeu(UUR) MELAS PEO mtRNALeu(CUN) mtRNAAsn mtRNAGln: PEO-plus mtRNAAla: PEO-plus mtRNATyr: PEO-plus mtRNALys: PEO-plus mtRNAIle mtRNAPro |
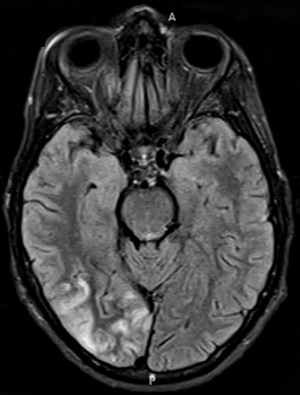
PEO sporadica Alterazioni del DNA mitocondriale Singole delezioni del mtDNA, o Delezioni multiple del mtDNA Kearns-Sayre: Grande delezione del mtDNA PEO + miopatia prossimale Neuropatia sensoria atassica ? Immunitaria (Ipertiroidea) 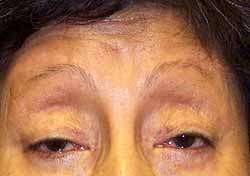
|
|
|
|
Disturbi del mtDNA PEO: 4366insA Sordità e emicrania: A4336G MELAS: A4332G Disturbi del DNA nucleare QRSL1: COXPD40 GATB: COXPD41 GATC: COXPD42 |
| PEO autosomiche dominanti: Caratteristiche cliniche | |||
|
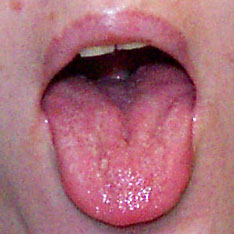
Lingua con tre solchi
|
||
|
Diagnosi differenziale |
|||
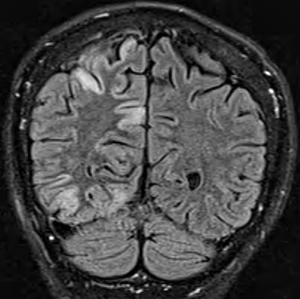
MSCAE
|
|
Autosomiche dominanti Autosomiche Recessiva Materna Sporadica Mioglobinuria |
|
Citocromo c ossidasi : Subunità 2 Mutazioni del tRNA mitocondriali Miopatie sporadiche |
|
Esordio in età adulta Anemia Atassia Cardiaco Sordità Diabete Encefalopatie infantili Lipomatosi multipla simmetrica Atrofia ottica |
|
|
Sindromiche ad eredita autosomica recessiva Wolfram (DIDMOAD): WFS1; WFS2 Sindrome sordità-distonia Ereditarietà materna (mitocondriale) non sindromica Sindromica Sindromica sporadica |
|
DNA mitocondriale LHON DNA nucleare
|
|
Caratteristiche Cliniche Laboratorio Tipi |
|
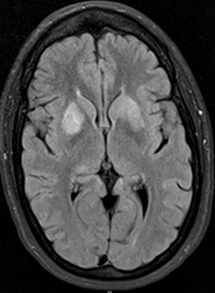 Da: R Bucelli |
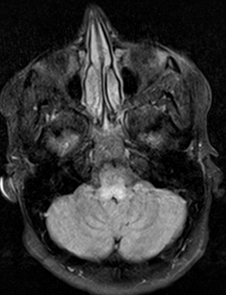 Da: R Bucelli |
||||||||||||||||||
|
Mutazioni mitocondriali (MILS) Generale Complesso I MTND1 MTND2 MTND3* MTND4 MTND5* MTND6* Complesso IV COX III (MTCO3) Complesso V ATPasi 6 (MTATP6)* tRNAs MTTI (Ile) MTTK (Lys) MTTL1 (Leu) MTTL2 (Leu) MTTS2 (Ser) MTTV (Val) MTTW (Trp) delezioni del mtDNA (LS) * Causa comune di LS |
|
Processi della valina L-Valina ↓ 2-Osso-isovalerato (2-Chetoisovalerato) ↓ Isobutirril-CoA ↓ ACAD8 Metacrilil-CoA ↓ ECHS1 (S)-3-Idrossiisobutiril-CoA ↓ HIBCH (S)-3-Idrossiisobutirrato ↓ (S)-3-Metilmalonico semialdeide ↓ Acriloil-CoA ← Propionil-CoA ↓ ECHS1 ↓ 3-idrossipropionil-CoA Metilmalonil-CoA ↓ ↓ 3-Idrossipropionato Succinil-CoA ↓
Semialdeide malonica |
|
|
Triossido di arsenico: Miopatia Rame: CNS Doxorubicina: Cardiomiopatia Germanio: Miopatia Ixabepilone: Neuropatia Nucleosidi AZT: Miopatia Clevudina: Miopatia Generale Neuropatia Telbivudina: Neuropatia; Miopatia Tricloroetilene (TCE): Neuropatia Valproato: Miopatia; CNS |
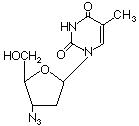 AZT |
|
PGL1: SDHD; 11q23 PGL2: SDHAF2; 11q13 PGL3: SDHC; 1q21 PGL4: SDHB; 1p36 PGL5: SDHA; 5p15 PGL6: SLC25A11;17p13 PGL7: DLST; 14q24 |
|
|
|
Ritorno a Fonama.org Home Page |
Alla pagina originale
|
|