|
Fondazione FONAMA |
fonama@fonama.org |
Tel. 335250742 |
 |
 |
Traduzioni a cura di Natale Marzari
Dopo 41 anni e 5 mesi, nel maggio 2006 la
magistratura di Trento ha riconosciuto l'esistenza e la gravità di quella
malattia rara che nessuna altra istituzione o persona singola della provincia di
Trento ancora mi riconosce, e per negare la quale ancora mi perseguita.
Natale Marzari |
Biogenesi dei mitocondri
Il genoma umano mitocondriale è solo 16,6kb e tra i più piccoli nel regno umano. Il cromosoma circolare fu completamente sequenziato dal gruppo di Sanger nel 1981 e la mappa viene mostrata
qui sotto:
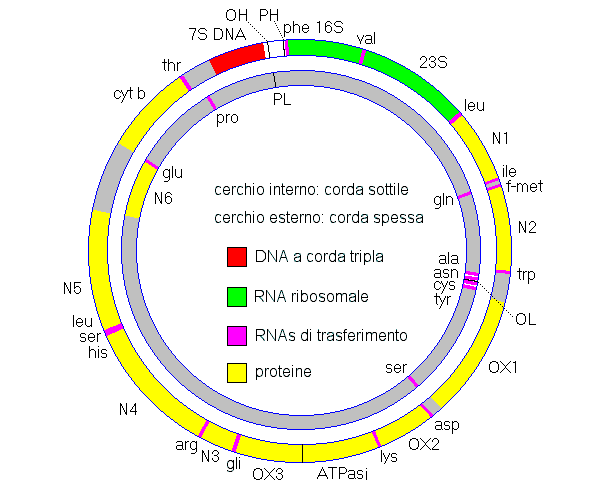
Il filamento H più spessa ha un più alto contenuto di guanina, e in questa mappa è trascritta in senso orario come una singola molecola di RNA che parte dal promotore PH.
Il filamento L
leggero è trascritto in senso antiorario a partire dal dal promotore PL. Entrambi i trascrittori RNA
vengono successivamente staccati per rendere funzionali le molecole RNA. La
replicazione del filamento pesante da parte della DNA polimerasi inizia in senso antiorario dall'origine della replicazione OH; questo alla fine espone l'origine OL
consentendo il completamento della replicazione del filamento leggero. La regione colorata in rosso vicino ai promotori è conosciuta come D-loop e contiene una breve DNA a
triplo filamento.
L'informazione genetica mitocondriale è un pacchetto molto denso. Non ci sono introni e solo minuscoli gap tra i geni. [Nella
mappa soprastante, N1 - N6 sono sottounità della NADH deidrogenasi, cyt b è il
citocromo b, OX1 - OX3
sono le sottounità della citocromo ossidasi, ed i geni per le due sottounità della ATPasi parzialmente sovrapposte]. Ci sono in tutto 37 geni mitocondriali, ma solo 13 di questi
codificano polipeptidi, i rimanenti sono le due sottounità ribosomali e 22 tipi di RNA di trasporto. Tutti le centinaia di altre proteine mitocondriali, incluse
la DNA polimerasi,
e la RNA polimerasi, aminoacidi che attivano enzimi e tutte le proteine ribosomali sono codificate dai geni nucleari ed importati dal citoplasma.
Ci sono circa 2000 copie di genoma mitocondriale in una tipica cella, così che
malgrado la sua piccola dimensione esso rappresenta circa il 0,5% della massa del DNA. La replicazione
del DNA mitocondriale appare essere meno accurata che la copiatura di quello nucleare, e
si è lontani dal capire come si mantiene la consistenza fra queste copie
multipleo come la loro replica è sincronizzata con il resto della cellula.
Ci sono sostanziali differenze tra le proteine presenti nei mitocondri nei diversi tessuti, riflettendo i
campioni tessuto specifici l'espressione dei geni nucleari. Il
ricambio delle proteine, comunque, sembra essere abbastanza lento e la composizione delle proteine mitocondriali non risponde molto rapidamente agli stimoli dietetici o ormonali. Il
numero totale di mitocondri per cellula può essere cambiato (per esmpio, attraverso l'attività muscolare) nel corso di diverse settimane.
L'importazione di proteine citosoliche dentro la matrice mitocondriale ha luogo in siti specializzati dove le membrane
interna e esterna sono in stretto contatto. I precursori citosolici sono marcati per l'importazione da una
sequenza guida terminale N, portante una carica
notevolmente positiva. Le pieghe guida per formare un' elica alfa anfipatica dove gli aminoacidi idrofobi sono concentrati lungo una faccia. Le proteine recettori nella membrana
esterna riconoscono i sotto gruppi di questi segnali di importazione, e aiutano ad indirizzare i precursori verso il canale di importazione. Le proteine mitocondriali sono solitamente più
basiche che le loro controparti citosoliche. Esse probabilmente hanno una carica positiva netta al pH fisiologico, e sono strettamente influenzate dal potenziale di membrana. Sembra che
il potenziale energetico protonico fornisca parte della energia per l'importazione di proteine.
Le proteine passano attraverso le membrane in una configurazione che si estenda linearmente. E' importante che esse non dovrebbero essere ripiegate completamente prima di
essere importate, poiché gli enzimi ripiegati correttamente non potrebbero passare attraverso il
poro. Il ripiegamento viene temporaneamente impedito nel citoplasma
attraverso la proteina chaperon hsp70, mentre due ulteriori chaperon mitocondriali hsp60 e hsp70 supervisionano
il ri-piegamentoa delle proteine importate dopo che esse sono
entrate nella matrice. L'idrolisi dell'ATP idrolisi viene richiesta nel citoplasma e nel mitocondrio per il successo dell'importazione delle proteine funzionali, in aggiunta al potenziale di
membrana e al gradiente pH. questa richiesta di ATP è probabilmente associata con il il ripiegamento proteico.
La sequenza matrice bersaglio è aperta dalle proteine importate da una
metrice proteasi. Se la proteina importata è destinata allo spazio intermembranico (ad es.
la miochinasi) si pensa che il distacco
della prima sequenza segnale esponga un secondo segnale rivolto alla re-esportazione della proteina attraverso la membrana interna. (la proteina
insolitamente piccola apo-citocromo c
apparentemente usa i canali non specifici della membrana esterna per raggiungere lo spazio intermembranico interno. La chelazione di eme, e la conseguente adozione della conformazione
della proteina nativa aggancia questa particolare proteina nella sua posizione finale).


